Table des matières
la maladie de Creutzfeldt-Jakob
Qu'Est-ce que c'est ?
La maladie de Creutzfeldt-Jakob fait partie des maladies à prions. Ce sont des maladies rares caractérisées par une dégénérescence du système nerveux central et sont également appelées encéphalopathies spongiformes transmissibles subaiguës (EST). Elles sont causées par l'accumulation dans le cerveau d'une protéine normale mais mal conformée, la protéine prion (1). Malheureusement, la maladie de Creutzfeldt-Jakob se caractérise par une évolution rapide et fatale ainsi que par l'absence de traitement. Il y a 100 à 150 cas chaque année en France (2).
Symptômes
La maladie débute souvent par des troubles non spécifiques tels que l'insomnie ou l'anxiété. Progressivement, des troubles de la mémoire, de l'orientation et du langage s'installent. Elle se manifeste alors par des troubles psychiatriques ainsi qu'une ataxie cérébelleuse (instabilité en position debout immobile et lors de la marche qui s'accompagne d'un vacillement semblable à celui de l'ivresse). Il existe également des lésions typiques du système nerveux central (plaques fleuries, dépôts amyloïdes de PrPres entourés de vacuoles).
Les deux sexes sont touchés, mais avec une fréquence élevée chez les jeunes adultes.
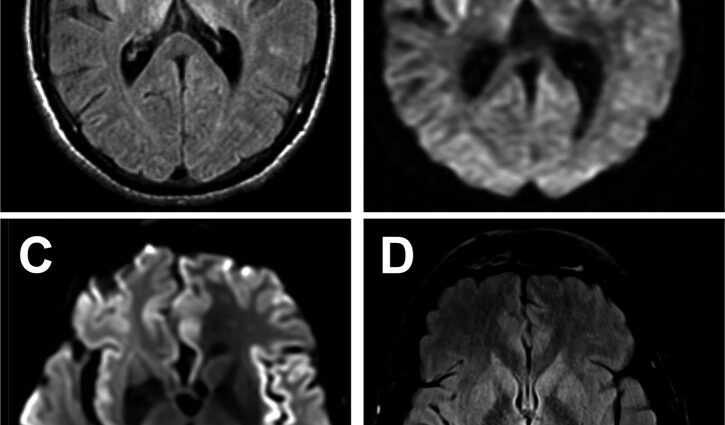
Malheureusement, il n'existe pas de test diagnostique fiable. Un électroencéphalogramme (EEG) permet d'identifier des perturbations relativement spécifiques de l'activité cérébrale. L'IRM révèle des anomalies spécifiques dans certaines régions du cerveau (noyaux de la base, cortex) pour lesquelles il existe peu de diagnostics différentiels.
Si tous ces éléments cliniques et paracliniques peuvent permettre de poser un diagnostic de maladie de Creutzfeldt-Jakob, il ne s'agit que d'un diagnostic probable : en effet, seul l'examen du tissu cérébral, réalisé plus souvent après le décès, permet de confirmer la diagnostic.
Les origines de la maladie
La maladie de Creutzfeld-Jakob est la seule maladie humaine pouvant être d'origine génétique (due à une mutation du gène codant pour la protéine prion, la mutation E200K étant la plus fréquente), de cause infectieuse (secondaire à une contamination) ou de forme sporadique (de occurrence aléatoire, sans mutation ni exposition à un prion exogène trouvé).
Cependant, la forme sporadique est la plus fréquente : elle représente 85 % de toutes les encéphalopathies spongiformes transmissibles subaiguës (EST) diagnostiquées chaque année. Dans ce cas, la maladie apparaît généralement après 60 ans et évolue sur une période d'environ 6 mois. Lorsque la maladie est génétique ou infectieuse, les symptômes sont plus précoces et progressent plus lentement. Dans les formes infectieuses, la période d'incubation peut être extrêmement longue et dépasser 50 ans.
Les facteurs de risque
La protéine prion (PrPc) est une protéine physiologique que l'on retrouve de manière très conservée chez de nombreuses espèces. Dans les neurones du cerveau, la protéine prion peut devenir pathogène en modifiant sa conformation tridimensionnelle : elle se replie sur elle-même de manière très serrée, ce qui la rend hydrophobe, peu soluble et résistante à la dégradation. Elle est alors appelée protéine prion « tremblante » (PrPsc). Les PrPsc s'agrègent les unes avec les autres et forment des dépôts qui se multiplient à l'intérieur et à l'extérieur des cellules cérébrales, perturbant leur fonctionnement et leurs mécanismes de survie.
Sous cette forme anormale, la protéine prion est également capable de transmettre son anomalie conformationnelle : au contact d'une PrPsc, une protéine prion normale adopte à son tour une conformation anormale. C'est l'effet domino.
Le risque de transmission entre individus
La transmission interindividuelle de maladies à prions est possible lors d'une transplantation tissulaire ou suite à l'administration d'hormones de croissance. Les tissus les plus à risque proviennent du système nerveux central et de l'œil. Dans une moindre mesure, le liquide céphalo-rachidien, le sang et certains organes (reins, poumons, etc.) peuvent également transmettre le prion anormal.
Le risque alimentaire
La transmission d'un prion du bétail à l'homme via la consommation d'aliments contaminés a été suspectée en 1996, lors de la dramatique crise de la « vache folle ». Depuis plusieurs années, une épidémie d'encéphalopathie spongiforme bovine (ESB) frappe des troupeaux au Royaume-Uni3. La propagation de cette maladie à prions, qui touchait des dizaines de milliers d'animaux chaque année, était sans doute due à l'utilisation de farines animales, produites à partir de carcasses et insuffisamment décontaminées. Son origine reste cependant débattue.
Prévention et traitement
Aujourd'hui, il n'existe pas de traitement spécifique pour les maladies à prions. Les seuls médicaments qui peuvent être prescrits sont ceux qui peuvent soulager ou limiter les différents symptômes de la maladie. Un soutien médical, social et psychologique est offert aux patients et à leurs familles par l'Unité nationale de soutien à la MCJ. La recherche de médicaments visant à empêcher la conversion de la PrPc, à favoriser l'élimination des formes anormales de la protéine et à limiter sa propagation est porteuse d'espoir. Une piste intéressante cible PDK1, l'un des médiateurs cellulaires impliqués lors de l'infection. Son inhibition permettrait à la fois d'inhiber le phénomène de conversion en favorisant le clivage de la PrPc, et d'atténuer les conséquences de sa réplication sur la survie des neurones.